PROLIFERAZIONE ANGIOMATOSA RETINICA (RAP)
Articolo redatto col prezioso aiuto dell’Oculista Dott. Filippo Confalonieri – Medico Chirurgo Specialista in Oftalmologia.
DEFINIZIONE ED EPIDEMIOLOGIA
La proliferazione angiomatosa retinica (RAP) può essere considerata una variante della degenerazione maculare legata all’età di tipo neovascolare, in cui la componente preponderante della proliferazione vascolare è, all’esordio, collocata nello spessore della retina [37]. Il termine proliferazione angiomatosa retinica (RAP) è stato proposto per la prima volta da Yannuzzi e dai suoi colleghi, i quali la definiscono come un sottogruppo distinto di DMLE essudativa e non semplicemente come una forma avanzata di DMLE neovascolare [38]. Oggi sappiamo che le lesioni peculiari della RAP possono originare non solo dai vasi retinici, ma anche dalla coroide, costituendo due centri di neovascolarizzazione, i quali hanno la capacità di crescere fino ad anastomizzarsi tra loro [39].
Sino a poco tempo fa, la prevalenza della RAP era difficile da valutare accuratamente a causa della mancanza di criteri diagnostici standardizzati e delle variazioni delle modalità di imaging utilizzate; quindi, la prevalenza della RAP è probabilmente stata sottovalutata negli studi meno recenti [40]. Grazie alla tecnologia Spectral Domain OCT (SD-OCT) e all’affinamento della FAG e ICGA, la frequenza di RAP tra i casi di DMLE neovascolare è stata stimata al 10%-20% nelle popolazioni caucasiche [37]. Inoltre, il coinvolgimento bilaterale è comune nei pazienti con RAP, tanto è vero che, in un gruppo di pazienti con malattia unilaterale, l’occhio controlaterale ha sviluppato la patologia nel 40% dei casi a 1 anno, nel 56% in 2 anni e nel 100% in 3 anni [41]. In confronto, solo circa il 43% dei pazienti con DMLE neovascolare unilaterale sviluppa la medesima controlateralmente entro 5 anni [42].
EZIOPATOGENESI
I precisi meccanismi eziologici e fisiopatologici all’origine della RAP non sono ancora del tutto noti [43]. Tuttavia si ritiene che, in modo simile alla CNV correlata alla DMLE classica, l’aumento di VEGF, l’ischemia e le alterazioni maculari legate all’età possano contribuire allo sviluppo della patologia. L’insufficienza dell’EPR nel modulare o inibire i fattori neovascolari è stata proposta come un potenziale evento iniziale che porta alla neovascolarizzazione intraretinica. L’iperespressione del VEGF, infatti, svolge un ruolo fondamentale nello sviluppo delle membrane neovascolari intraretiniche e subretiniche osservate nella RAP. Poiché la fovea riceve il suo approvvigionamento nutritizio prevalentemente dalla coroide, la disfunzione dell’EPR può compromettere la diffusione di ossigeno alla fovea, provocando l’accumulo di prodotti catabolici nello spazio sottoretinico e l’ispessimento della membrana di Bruch. Questo, a sua volta, può comportare un’ulteriore riduzione dell’ossigenazione interna della retina e soprattutto della fovea, così come lo sviluppo di DEP sieroso può ulteriormente esacerbare l’ipossia, spostando la retina foveale ancora più lontano dalla coroide [43].
Ad ogni modo, la caratteristica unica e peculiare della RAP consiste nella presenza di due centri di neovascolarizzazione: il primo localizzato nella retina profonda e l’altro all’interno della coroide [43], fino alla formazione di un’anastomosi retino-coroideale, motivo per il quale è stato suggerito il termine di neovascolarizzazione tipo 3 [37].
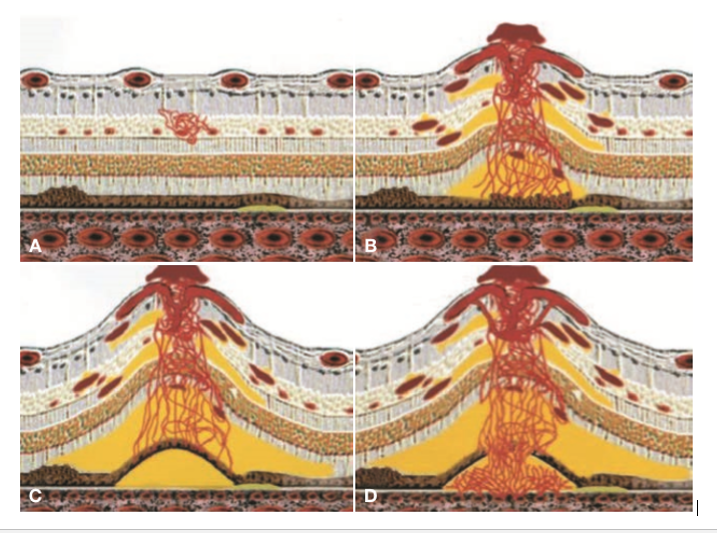
A seconda del momento fisiopatologico nel quale viene posta la diagnosi, la RAP viene classificata sulla base di tre stadi progressivi utilizzando la classificazione di Yannuzzi [38], la più diffusa.
Stadio 1: si rileva la presenza di un focus di neovascolarizzazione intraretinica (IRN). I capillari che derivano dal plesso capillare profondo della zona paramaculare proliferano all’interno della retina. Clinicamente si può osservare una massa nodulare di tessuto angiomatoso nello spessore della retina. L’IRN progredisce verticalmente con qualche estensione laterale e, già in questo stadio, si possono rilevare anche emorragie ed edema intraretinico [37][38][44].
Stadio 2: è a sua volta suddiviso in stadio 2A e 2B, rispettivamente senza o con il DEP. In entrambi i casi, comunque, lo stadio 2 di RAP viene diagnosticato quando l’IRN si estende più in profondità nello spazio subretinico, oltre lo strato fotorecettoriale, con conseguente neovascolarizzazione sottoretinica (SRN). Le caratteristiche cliniche in questa fase includono: il distacco di retina neurosensoriale, l’aumento dell’edema e delle emorragie intraretiniche. Talvolta si può vedere un’arteriola afferente e una venula drenante. Questo reperto serve come base per il trattamento con la terapia di fotocoagulazione laser, come discusso nella sezione successiva. Infine, allorquando la neovascolarizzazione sottoretinica si fondesse con l’EPR, si può sviluppare un DEP sieroso, che caratterizza lo stadio 2B [37][38][44].
Stadio 3: si riferisce alla CNV con un DEP vascolarizzato e un’antastomosi retino-coroidale (RCA). In questo stadio, la presenza di CNV è ben evidente sia clinicamente che angiograficamente e si associa spesso ad una cicatrice disciforme [37][38][44].
(A) Stadio 1 (B) Stadio 2A (C) Stadio 2B (D) Stadio 3[44]
SEGNI E SINTOMI
La presentazione clinica è simile a quella della DMLE essudativa classica, da cui si distingue per DEP ed essudati più frequenti e per le multiple emorragie superficiali [37]. In estrema sintesi, dunque, i risultati tipici all’esame del fundus oculi suggestivi di RAP includono: emorragie intraretiniche superficiali ed edema, essudati duri, distacco dell’epitelio pigmentato (DEP) e anastomosi retino-coroideali [45]. Come accennato in precedenza, i pazienti con RAP sono anche più propensi a presentare una malattia bilaterale, simultanea o sequenziale. L’acuità visiva nei pazienti con RAP è variabile e si può correlare allo stadio della malattia. In futuro, migliorando la consapevolezza clinica e le tecniche di imaging, è probabile che le lesioni della RAP siano sempre più diagnosticate nelle fasi precoci, quando la vista è ancora relativamente preservata [43].
DIAGNOSI
La diagnosi di RAP può essere posta tramite l’indagine clinica associata a OCT, FAG e ICGA. L’OCT mostra la neovascolarizzazione come un’area iperreflettente. La FAG è di solito simile a CNV occulte o minimamente classiche, ma può mostrare un’iperfluorescenza focale intraretinica. L’ICGA può mostrare i cosiddetti ‘’hot spots’’, ovvero un’area di iperfluorescenza nelle scansioni medie e/o tardive, talvolta accompagnate da un’arteriola afferente e una venula efferente che si possono anche unire (configurando un’immagine a forcella o hairpin) [37].
Per quanto pertiene alla diagnosi differenziale, va ribadito che la presentazione clinica della RAP non è patognomonica. La diagnosi differenziale per la malattia di stadio 1 comprende la telangiectasia parafoveale o altre forme di maculopatia essudativa, come l’edema maculare diabetico, o l’occlusione venosa maculare retinica. I fattori differenziali includono la presenza di cristalli nella telangiectasia parafoveale e l’assenza di drusen nei pazienti con edema maculare diabetico od occlusione venosa maculare retinica. Lo studio per immagini con FA, ICGA e OCT è cruciale per differenziare le cause precedentemente citate. L’aspetto clinico della RAP in stadio 2 e 3 può sembrare simile a quello di CNV classica, CNV occulta o della vasculopatia coroidale polipoidale. Infatti, il DEP è comunemente visto sia nella vasculopatia coroidale polipoidale che nella DMLE. Anche in questi stadi, l’imaging svolge un ruolo fondamentale nella conferma della diagnosi di RAP e nel determinare lo stadio della malattia ed è particolarmente utile per aiutare a distinguere se l’origine della rete neovascolare derivi dalla circolazione retinica o coroideale [43].
TERAPIA
La terapia con inezioni intravitreali di anti-VEGF ha dimostrato risultati efficaci e rappresenta ad oggi la prima linea di trattamento [43]. Ci sono pochi dati sull’efficacia comparativa degli agenti anti-VEGF usati nel trattamento della RAP. Parodi e colleghi hanno eseguito uno studio prospettico che ha confrontato l’esito di 26 occhi trattati con bevacizumab e 24 occhi trattati con ranibizumab in cui hanno trovato che entrambi gli agenti sono stati efficaci, nell’arco di un anno, nel migliorare l’acuità visiva in occhi con stadio 1 e 2 di RAP. Tuttavia, il 90% dei DEP si è risolto nel gruppo ranibizumab, rispetto al 40% nel gruppo bevacizumab [46].
Risultati favorevoli sono stati riscontrati anche con l’associazione di iniezioni intravitreali di anti-VEGF e PDT. Al contrario, la PDT in monoterapia e la fotocoagulazione dei vasi afferenti alla neoformazione si sono dimostrati di scarsa efficacia, benché la seconda possa essere utilizzata in casi refrattari [37].
FONTI:
- B. Bowling: «Kanski’s Clinical Ophthalmology, a systematic approach». 8th edition, Elsevier, 2016, pag. 616.
- L.A. Yannuzzi, S. Negrão, T. Iida, et al.: «Retinal angiomatous proliferation in age-related macular degeneration». Retina, 21 (5) (2001), pp. 416–434.
- L.A. Yannuzzi, K.B. Freund, B.S. Takahashi: «Review of retinal angiomatous proliferation or type 3 neovascularization». Retina, 28 (3) 2008, pp. 375–384.
- F. Viola, A. Massacesi, N. Orzalesi, R. Ratiglia, G. Staurenghi: «Retinal angiomatous proliferation: natural history and progression of visual loss». Retina, 29 (6) (2009), pag. 732–739.
- N.E. Gross, A. Aizman, A. Brucker, J.M. Klancnik, L.A. Yannuzzi: «Nature and risk of neovascularization in the fellow eye of patients with unilateral retinal angiomatous proliferation». Retina, 25 (6) (2005), pag. 713–718.
- N.M. Bressler, S.B. Bressler, N.G. Congdon, et al.: «Potential public health impact of Age-Related Eye Disease». Study results: AREDS report no. 11, Arch Ophthalmol, 121 (11) (2003), pp. 1621–1624.
- Tsai AS, Cheung N, Gan AT, Jaffe GJ, Sivaprasad S, Wong TY, Cheung CM: «Retinal angiomatous proliferation». Survey of Ophthalmology an international review journal, 2017, pii: S0039-6257(16)30088-1. doi: 10.1016/j.survophthal.2017.01.008.
- N. Yoshimura, M. Hangai: «OCT Atlas». Springer, 2014, pp. 212-219.
- M.A. Hunter, M.T. Dunbar, P.J. Rosenfeld, Retinal angiomatous proliferation: «Clinical characteristics and treatment options». Optometry, 75 (9) (2004), pp. 577–588.
Articolo tratto, con permesso dell’Autore, dalla tesi di laurea magistrale in Medicina e Chirurgia del Dott. Filippo Confalonieri, redatta presso la Clinica Oculistica della Fondazione IRCCS Policlinico San Matteo di Pavia, Università degli Studi di Pavia, 2017.