FATTORE DI CRESCITA DELL’ENDOTELIO VASCOLARE (VEGF) & FARMACI INIBITORI DEL FATTORE DI CRESCITA DELL’ENDOTELIO VASCOLARE (anti-VEGF)
Per fattore di crescita dell’endotelio vascolare (VEGF) si intende una famiglia di piccole molecole, secrete secondariamente a processi ischemici retinici, che hanno la capacità di agire sulle cellule endoteliali inducendo neoangiogenesi e iperpermeabilità vascolare. All’interno della suddetta famiglia si distinguono le seguenti molecole: VEGF-A, VEGF-B, VEGF-C, VEGF-D e il placental growth factor (PlGF), le quali si legano selettivamente ad almeno cinque differenti recettori [62 pag. 8-10]. Tra tutte queste piccole molecole, la più studiata è il VEGF-A, prodotto da molti tipi di cellule nella retina, compreso l’epitelio pigmentato retinico, oltre alle cellule endoteliali vascolari, ai periciti, ai neuroni retinici, alle cellule di Müller e agli astrociti, facendo supporre che esso abbia funzioni importanti nell’omeostasi oculare [63].
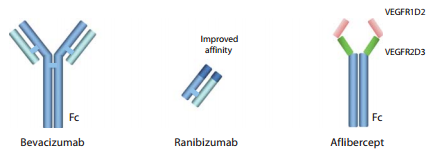
Sino ad oggi sono stati utilizzati quattro farmaci inibitori del fattore di crescita dell’endotelio vascolare per il trattamento di pazienti con DMLE neovascolare: pegaptanib (Macugen), bevacizumab (Avastin), ranibizumab (Lucentis) e aflibercept (EYLEA) [63].
Pegaptanib è un aptamero, ossia un oligonucleotide a catena singola in grado di legare specificamente, e quindi inibire, il VEGF-A 165, una isoforma del VEGF-A che si differenzia dalle altre per splicing alternativo del corrispondente mRNA, e che ha un ruolo cruciale nella neoangiogenesi e nel leakage vascolare [64 pag. 1-2]. Pegaptanib è oggi sostanzialmente ormai superato dalle altre molecole [63].
Bevacizumab è un anticorpo monoclonale umanizzato in grado di legare tutte le isoforme di VEGF-A formando complessi incapaci di attivare i rispettivi siti recettoriali, e quindi inibendo la neoangiogenesi e permeabilità vascolare. L’utilizzo di bevacizumab in campo oftalmologico è off-label poiché esso trova indicazione terapeutica solo in ambito oncologico [64 pag. 4] e, in particolare, come associazione per la cura del carcinoma colorettale metastatico, carcinoma mammario metastatico, carcinoma polmonare non a piccole cellule avanzato o metastatico, carcinoma renale avanzato o metastatico, carcinoma ovarico epiteliale, carcinoma delle tube di fallopio e carcinoma peritoneale primario in stadio avanzato [65].
Ranibizumab è un frammento anticorpale derivato da bevacizumab che si caratterizza per essere approvato specificamente per la terapia in oftalmologia. Ranibizumab è di dimensioni molto minori rispetto a bevacizumab, ha una maggiore affinità per le isoforme di VEGF-A in quanto frutto del processo immunologico di affinity maturing e, poiché ideato e sviluppato appositamente per agire a livello intravitreale, ha un tempo di emivita sistemico considerevolmente inferiore, dell’ordine di due ore a livello plasmatico, contro i venti giorni di bevacizumab [62 pag. 26-30] [63]. Un importante studio, denonominato Comparison of AMD Treatment Trials (CATT), ha confermato che bevacizumab non è inferiore a ranibizumab a 12 mesi per quanto riguarda l’azione curativa a livello oculare [66]. Tuttavia, a livello sistemico, in uno studio retrospettivo sul database Medicare si è constatato che il rapporto di rischio (HR) per ictus cerebri fosse aumentato in maniera statisticamente significativa nei pazienti trattati con bevacizumab rispetto a quelli trattati con ranibizumab [67]. Un’ulteriore analisi del database succitato ha mostrato un incremento dell’11% di mortalità complessiva e un rischio di emorragia cerebrovascolare superiore del 57% per il bevacizumab su un periodo di follow-up di 10 mesi. Tuttavia, questo studio era limitato da informazioni incomplete su importanti fattori di confusione quali il fumo, la dislipidemia e la pressione arteriosa [68].
Aflibercept è l’ultima molecola ad essere stata immessa sul mercato farmaceutico. Il suo meccanismo d’azione è simile a quello di bevacizumab e ranibizumab ma, anziché essere un anticorpo monoclonale o una frazione del medesimo, è una proteina di fusione contenente i domini recettoriali di VEGFR1 e VEGFR2. Tutto questo fa sì che aflibercept sia in grado di legare non solo tutte le isoforme di VEGF-A ma anche il VEGF-B e il PlGF, formando con essi complessi stabili [63].
Conformazione strutturale delle molecole Bevacizumab, Ranibizumab e Aflibercept [63].
Fonti:
- 62. F. Bandello, M. Battaglia Parodi: «Anti-VEGF». Developments in Ophthalmology, Vol. 46, Series Editors F. Bandello Milan W. Behrens-Baumann Magdeburg, Karger, 2010.
- 63. Victor Chong: «Biological, Preclinical and Clinical Characteristics of Inhibitors of Vascular Endothelial Growth Factors». Ophthalmologica. 2012;227 Suppl 1:2-10. doi: 10.1159/000337152.
- 64. L. A. Barquet: «Actualización de Terapia Anti-VEGF en enfermedades de la retina y coroides». Elsevier, 2010.
- 65. AIFA, Bevacizumab, scheda tecnica del farmaco.
- 66. CATT Research Group, Martin DF, Maguire MG, Ying GS, Grunwald JE, Fine SL, Jaffe GJ.: «Ranibizumab and bevacizumab for neovascular age-related macular degeneration (CATT Study) ». New England Journal of Medicine, 2011, 19;364(20):1897-908. doi: 10.1056/NEJMoa1102673.
- 67. L. Curtis, Hammill BG, Schulman KA, Cousins SW: «Risks of mortality, myocardial infarction, bleeding, and stroke associated with therapies for age-related macular degeneration». Archives of Ophthalmology, 2010, 128(10):1273-9. doi: 10.1001/archophthalmol.2010.223.
- 68. Emily W. Gower, Sandra Cassard, Laura Chu, Rohit Varma, Ronald Klein: «Adverse Event Rates Following Intravitreal Injection of Avastin or Lucentis for Treating Age-Related Macular Degeneration». Investigative Ophthalmology & Visual Science, April 2011, Vol.52, 6644.
Articolo tratto, con permesso dell’Autore, dalla tesi di laurea magistrale in Medicina e Chirurgia del Dott. Filippo Confalonieri, redatta presso la Clinica Oculistica della Fondazione IRCCS Policlinico San Matteo di Pavia, Università degli Studi di Pavia, 2017.